Un estudio del Instituto de Investigaciones Biomédicas Sols-Morreale (IIBM-CSIC-UAM) liderado por Miguel Sánchez Álvarez ha identificado un nuevo mecanismo celular que permite a las células adaptar su arquitectura interna en situaciones de estrés. El hallazgo, publicado en la revista Cell Reports, muestra que una proteína denominada PERK actúa reorganizando el espacio interior de la célula para que esta pueda seguir funcionando correctamente.
Hasta ahora se sabía que PERK ayuda a frenar la producción de nuevas proteínas cuando la célula está saturada. Pero este nuevo trabajo revela que también desempeña un papel fundamental en cómo se redistribuyen los compartimentos internos, especialmente una estructura clave conocida como retículo endoplásmico (RE), responsable de fabricar muchas de las proteínas que necesita.
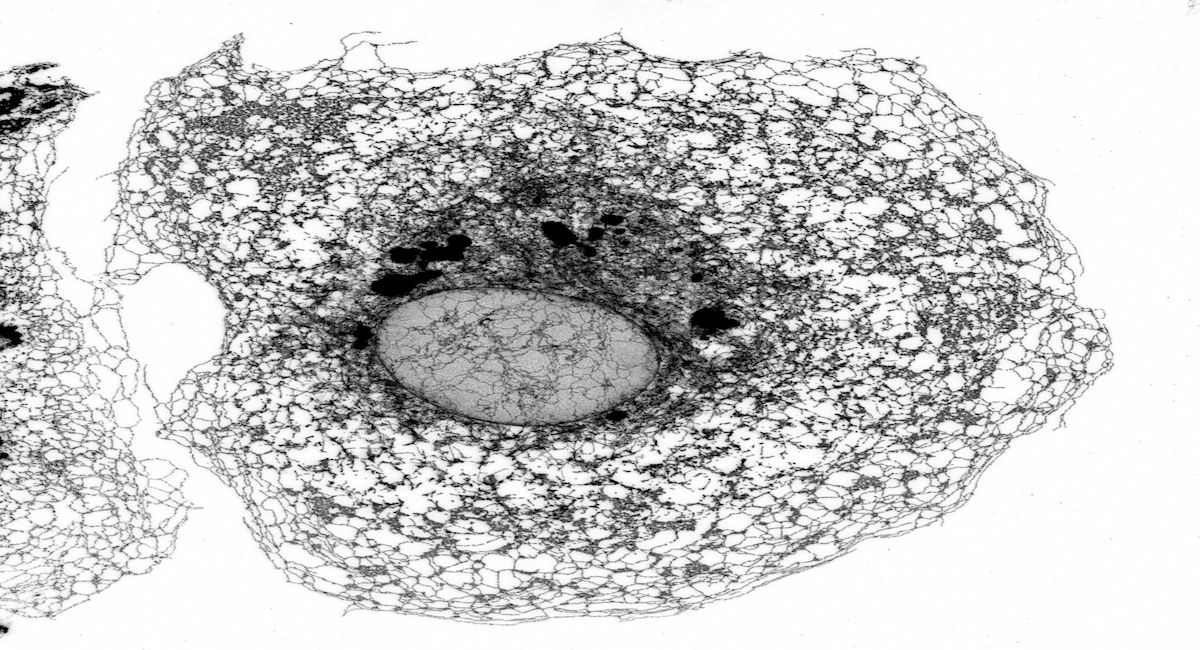
El retículo endoplásmico es una compleja red de membranas que realiza tareas esenciales, como la formación y maduración de al menos el 30% de las proteínas de la célula. La arquitectura de esta red de membranas debe adaptarse a la forma de cada tipo de célula, que puede variar según sean pequeñas, como linfocitos con forma esférica, o neuronas, con prolongaciones que llegan a medir varios centímetros. Además, el retículo endoplásmico debe ajustarse a las necesidades cambiantes de la célula y cuando no funciona en condiciones óptimas, una situación conocida como “estrés del retículo endoplásmico”, las células tienden a reestructurarlo y aumentar su volumen.
El control preciso de la arquitectura de esta red de membranas es crucial para la supervivencia y el correcto funcionamiento de los diferentes tipos de células en el organismo, pero aún se desconoce en gran medida cómo se lleva a cabo este control y cómo se coordina con los cambios en la forma de la célula.
Microscopía automatizada para el estudio de enfermedades
Los investigadores utilizaron una metodología avanzada de microscopía de alto contenido (high-content microscopy), que permite capturar imágenes del retículo endoplásmico en cientos de miles de células y analizar su estructura de manera automatizada. Esto posibilita la realización, en tiempos razonables, de un cribado en el que se anula uno a uno la expresión de miles de genes para estudiar su impacto en la función celular.
El estudio reveló que una proteína de respuesta a estrés del retículo endoplásmico, PERK, desempeña un papel más amplio de lo que se pensaba anteriormente. No sólo limita la producción de nuevas proteínas cuando se activa por estrés del retículo endoplásmico, sino que también es esencial para que la expansión del retículo endoplásmico se acomode correctamente dentro del volumen celular.
“Uno de los primeros hallazgos inesperados de este estudio fue que cuando PERK se activa, no sólo reduce la síntesis de proteínas, sino que también relaja el anclaje entre el retículo endoplásmico y los microtúbulos del citoesqueleto (red de proteínas que organiza la forma de las células), permitiendo que el retículo endoplásmico se expanda y se distribuya de manera adecuada dentro de la célula”, explica Miguel Sánchez. Los microtúbulos implicados en el proceso de unión con el retículo endoplásmico son los denominados no centrosomales, y están relacionados con la orientación, organización y migración de las células de forma polarizada, en una dirección concreta.
Los investigadores se preguntaron si la activación de PERK también influiría en la estabilidad de los propios microtúbulos.
“Aquí llegó otro hallazgo inesperado”, apunta el director del estudio. “Descubrimos que el grado de anclaje entre el retículo endoplásmico y los microtúbulos, que está fuertemente influenciado por la actividad de PERK, también afecta la estabilidad de estos microtúbulos”.
En células sometidas a estrés del retículo endoplásmico —por ejemplo, tras la exposición a tunicamicina, un veneno que provoca la acumulación de proteínas inmaduras en el retículo endoplásmico —, PERK desactiva la maquinaria de síntesis de proteínas y debilita la unión del retículo endoplásmico con los microtúbulos, facilitando su expansión física. Pero debilitar el anclaje entre el retículo endoplásmico y los microtúbulos tiene un efecto adicional: disminuye la estabilidad de los propios microtúbulos no centrosomales, en un proceso de retroalimentación negativa. “Esto confirma que el control de la arquitectura del retículo endoplásmico y la estabilidad y dinámica de los microtúbulos están estrechamente coordinados y, muy relevante, que podemos manipular artificialmente este sistema”, concluye Sánchez.
Relevancia en biomedicina
Este sistema dinámico explica otra observación notable del estudio. “La morfología y el comportamiento móvil de la célula están, en parte, condicionados por el estado funcional del RE y el control de la síntesis de proteínas a través de PERK”, explica Miguel Sánchez. “Cuando las células experimentan un alto estrés del retículo endoplásmico y activan PERK, reducen el anclaje del retículo endoplásmico a los microtúbulos no centrosomales para permitir su expansión. Sin embargo, esto también disminuye la estabilidad y abundancia de estos microtúbulos, lo que hace que las células adopten un estado más estático, sin una organización claramente polarizada y con menor capacidad de migración”, añade.
“Por el contrario, las células con una actividad reducida de PERK mantienen un alto grado de anclaje entre el retículo endoplásmico y los microtúbulos. Esto puede dificultar la reorganización del retículo endoplásmico, pero también estabiliza los MTs no centrosomales, promoviendo una morfología con protrusiones grandes y estables”.
Estos resultados son importantes porque proporcionan claves para entender mejor muchas enfermedades diferentes en las que las células cambian su forma o comportamiento. Es el caso de ciertos trastornos neurológicos o de células tumorales que se preparan para diseminarse por el cuerpo, así como en enfermedades neurológicas como la paraparesia espástica o ciertos síndromes de demencia. De hecho, los investigadores han observado que la reducción de la actividad de PERK estabiliza la formación de los axones durante la diferenciación de neuronas, lo que podría influir en procesos como la memoria y el aprendizaje.
También podrían ayudar a comprender mejor el papel del estrés del retículo endoplásmico en el cáncer. “La capacidad de las células cancerosas para adaptarse a este desequilibrio no solo influye en su supervivencia, sino que también puede modificar su comportamiento migratorio, un factor clave en la metástasis”, explica Chris Bakal. “El nivel de detalle que estamos alcanzando en la comprensión de estos procesos —y, sobre todo, cómo se relacionan entre sí— podría allanar el camino para encontrar nuevas estrategias terapéuticas en distintas enfermedades”, concluye Miguel Sánchez.